La Meccanica Quantistica pt. 2 - Effetto fotoelettrico e modello di Bohr
- D. e M.

- 17 giu 2020
- Tempo di lettura: 5 min
Nello scorso post abbiamo visto come Planck abbia dato inizio alla meccanica quantistica quasi senza saperlo, introducendo la quantizzazione delle energie. In questo invece studieremo i lavori di altri due grandissimi scienziati: Niels Bohr e Albert Einstein.
Abbiamo deciso di proporre questi due risultati assieme sia perché forniscono due validi esempi di come la meccanica quantistica sia stata usata, fin dai suoi primi anni, per risolvere problemi di grande importanza, sia perché troviamo quasi ironico proporre questo lavoro di Einstein, soprattutto se affiancato a quello di Bohr.
Einstein infatti non accettò mai la meccanica quantistica come una teoria completa, scontrandosi con l’opinione di Bohr, che ne fu fin da subito un grande sostenitore. Tuttavia, fu proprio Einstein ad essere uno dei primi ad usarla per spiegare un fenomeno mai compreso con la meccanica classica.
Tutti siamo a conoscenza del genio di Einstein, dei suoi lavori sulla relatività ristretta (1905) e generale (1915). Tuttavia non fu per questi che vinse il Nobel per la fisica nel 1921, ma per la spiegazione dell’effetto fotoelettrico, pubblicata sempre nel 1905.

(credit: Wikipedia)
Se una lastra di metallo è colpita da radiazione elettromagnetica (cioè luce) con una particolare energia, emette elettroni. Questo fenomeno fu scoperto da Hertz nel 1887.
Si fecero vari esperimenti, per mettere in relazione l’incidenza della luce con l’emissione degli elettroni. Secondo la fisica classica, l'energia della luce dipende dalla sua intensità; tuttavia, aumentando l’intensità della luce incidente, non aumentava l’energia degli elettroni, ma solo il loro numero. Si scoprì inoltre che l’energia degli elettroni aumentava all’aumentare della frequenza della luce e che, al di sotto di una certa frequenza, non vi è proprio emissione di elettroni.
Nelle teorie classiche, non vi era nessuna relazione tra energia e frequenza; per questo motivo l’effetto fotoelettrico non trovava spiegazione. Fu Einstein a riprendere la relazione di Planck, vista nello scorso post, e ad assumere che la luce possa essere assorbita solo in quanti di energia E = h ⋅ v; i quanti di luce verranno successivamente chiamati fotoni. Questo mise in relazione l’energia della luce con la sua frequenza v. Invece h è la costante di Planck, anche se all’epoca questo non era noto; Einstein sapeva che, per eguagliare le dimensioni delle varie grandezze, ci doveva essere una costante, ma non ne conosceva il valore. Fu solo nel 1914, con Millikan, che si scoprì che questa costante coincide con quella risultante dal problema del corpo nero.
All’inizio, questa interpretazione di Einstein non fu accettata da tutta la comunità scientifica; Planck stesso riteneva impossibile l’esistenza dei fotoni, credendo che i quanti fossero solo un espediente matematico per far tornare i conti. Tuttavia, numerosi esperimenti successivi diedero ragione ad Einstein. Questa situazione è quasi comica, perché negli anni successivi i ruoli si sarebbero invertiti: infatti Einstein sarà uno dei più aspri critici di alcuni risultati ottenuti dalla meccanica quantistica, ritenendoli impossibili. È diventata famosa la sua massima Dio non gioca a dadi con l'Universo, detta per criticare l’aspetto probabilistico della meccanica quantistica.
Non abbiamo ancora detto come mai non c’è emissione di fotoni al di sotto di una certa frequenza; per farlo bisogna prima spiegare i risultati ottenuti da un altro fisico, celeberrimo “nemico” di Einstein; ma andiamo con ordine. Sembra strano, poiché adesso è insegnato a tutti fin quasi dalle elementari, ma fino ad un secolo fa non si sapeva ancora come fosse fatto un atomo.
(credit: Wikipedia)
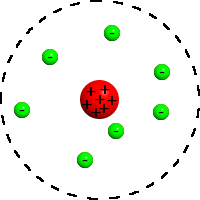
Nel 1911, dopo aver condotto un esperimento con una sottile lamina d’oro per capire la struttura dell’atomo, il fisico Ernest Rutherford propose il suo modello. Secondo lui, l’atomo è composto da un nucleo centrale, attorno a cui ruotano gli elettroni. Questo modello è spesso chiamato planetario: il nucleo è il Sole, mentre gli elettroni sono i pianeti che gli orbitano attorno.
Il modello di Rutherford è basato sulla fisica classica e presenta numerosi problemi. Infatti, una particella carica che accelera irradia, cioè trasforma una parte della propria energia in luce. L’elettrone che orbita attorno al nucleo dovrebbe quindi irradiare e perdere ben presto tutta la propria energia cinetica, cadendo nel nucleo. Inoltre, gli atomi di uno stesso elemento sono tutti uguali; invece nel modello planetario l’orbita dell’elettrone dipenderebbe dalle condizioni iniziali, cioè da come l’elettrone è stato catturato dal nucleo. Secondo questo modello, prendendo 100 atomi di carbonio, ad esempio, avremmo 100 atomi con forma e dimensione diverse, poiché ogni atomo ha le proprie condizioni iniziali.
Due anni più tardi, fu Bohr a proporre il suo modello atomico, partendo da quello proposto da Rutherford e dalla relazione di Planck-Einstein E = h ⋅ v, vista in precedenza. Alla base del suo modello, Bohr ipotizzò che:
1) le orbite degli elettroni fossero circolari;
2) la massa dell’elettrone sia molto minore di quella del protone e che l’elettrone viaggi ad una velocità molto inferiore a quella della luce;
3) il momento angolare L dell’elettrone sia quantizzato, cioè che possa assumere solo certi valori: L = ħ ⋅ n dove n è un numero intero (n = 1, 2, 3 …) e ħ (si legge acca tagliato) è una costante, all'epoca sconosciuta.
Bohr portò avanti i calcoli e scoprì che nel suo modello gli elettroni non possono stare ad una distanza qualsiasi dal nucleo, ma solo a certe distanze ben specifiche. Dunque anche le orbite sono quantizzate e vengono chiamate orbitali; questo risolse il problema di come facciano gli atomi ad essere tutti uguali e non avere orbite che dipendono dalle condizioni iniziali.
Un elettrone si posiziona sempre nell’orbitale libero più interno, perché è quello che ha energia minore (la Natura è pigra, cerca sempre di avere la minima energia). Tuttavia, può passare ad un orbitale più esterno, basta che gli si fornisca dell’energia. Questa energia non può essere casuale, ma deve essere almeno equivalente alla differenza di energia dei due orbitali, perché l’orbitale più esterno ha energia maggiore.

(credit: DucaTV)
Dunque, se si fornisce all’elettrone la giusta energia lo si può far “saltare” su un orbitale più esterno; in tal caso si dice che l’elettrone è eccitato. Se invece avviene il processo contrario, cioè l’elettrone passa da un orbitale esterno ad uno interno, emette energia sotto forma di fotoni. Questi hanno esattamente l’energia che separa i due orbitali tra cui l’elettrone è saltato.
Bohr unì a questi suoi risultati la relazione di Planck-Einstein e scoprì che la costante ħ era parente della costante di Planck; infatti h = 2π ⋅ ħ (ħ viene chiamata anche costante di Planck ridotta).
Questo modello spiega bene l’atomo di idrogeno, il più semplice possibile, ma i suoi calcoli diventano molto complicati, quasi irrisolvibili, per atomi più complessi. Tuttavia il principio di funzionamento è lo stesso: agli elettroni serve energia per passare ad un orbitale più esterno e emettono energia quando rientrano in un orbitale più interno.
Ora possiamo comprendere come mai, nell’effetto fotoelettrico, non vi è emissione di elettroni se la frequenza della luce non supera una certa soglia. Quella soglia rappresenta l’energia che serve alla luce per far passare l’elettrone all’orbitale più esterno, all’ultimo gradino prima che possa essere considerato libero e non più sotto l’influenza del nucleo. Solo superando questa soglia gli elettroni possono sfuggire dal nucleo ed essere rilevati dagli strumenti; al di sotto, invece, la luce fa passare gli elettroni da un orbitale ad un altro, ma sempre all’interno dell’atomo.
Per approfondire:
Due articoli sulla vita dei due grandi scienziati protagonisti di questo post
Articolo sulla relazione di Planck-Einstein
Due articoli sull'effetto fotoelettrico
Due articoli sui due modelli atomici presentati in questo post
Dubbi o curiosità? Lascia un commento





Commenti